Химия (43)
Публикации, статьи и материалы по химии для учителей, педагогов и родителей





















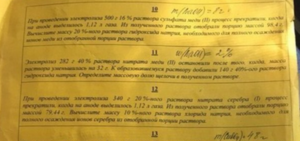


Публикации, статьи и материалы по химии для учителей, педагогов и родителей